경금속 표면개질 시 황산 수용액 조건에 따른 내식성 개선 효과
Copyright © The Korean Society of Marine Engineering
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0), which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
초록
표면개질이란 재료 본연의 특성만으로 원하는 성능과 기능을 발휘할 수 없는 때 기재 표면에 열에너지, 응력 등을 부가하여 새로운 표면층을 형성하는 방법으로, 소지금속의 방청, 외관미화, 내마모성, 전기절연, 전기전도성 부여 등의 폭넓은 목적을 달성시키고자 하는 일련의 조작을 말한다. 이러한 표면개질에는 도금, 화성처리, 도장, 라이닝, 코팅, 표면경화 등이 있다. 그 중 전해액을 이용한 표면개질은 오래전부터 공업적으로 활용하기 위한 연구가 많이 이루어져 왔으며, 원가절감과 높은 생산성, 그리고 복잡한 형상에 대한 적용이 가능해 여러 분야에서 각광받고 있다. 따라서 본 연구에서는 5083-O 알루미늄 합금을 이용해 해양환경에서 우수한 내식성을 보유할 수 있는 최적의 표면개질 전해액 온도를 선정하고자 전기화학 실험을 실시하였다. 실험 결과, 표면개질을 실시한 경우가 현저히 낮은 부식전류밀도를 나타냈으며, 특히 불완전 기공이 생성된 5 ℃를 제외하고 전해액 온도가 증가함에 따라 감소하는 결과를 나타냈다.
Abstract
Surface modification is a technology to form a new surface layer and overcome the intrinsic properties of the base material by applying thermal energy or stress onto the surface of the material. The purpose of this technique is to achieve anti- corrosion, beautiful appearance, wear resistance, insulation and conductance for base materials. Surface modification techniques may include plating, chemical conversion treatment, painting, lining and surface hardening. Among which, a surface modification process using electrolytes has been investigated for a long time in connection with research on its industrial application. The technology is highly favoured by various fields because it provides not only high productivity and cost reduction opportunities, but also application availability for components with complex geometry. In this study, an electrochemical experiment was performed on the surface of 5083-O Al alloy to determine an optimal electrolyte temperature, which produces surface with excellent corrosion resistance under marine environment than the initial surface. The experiment result, the modified surface presented a significantly lower corrosion current density with increasing electrolyte temperature, except for 5 ℃ of electrolyte temperature at which premature pores was created.
Keywords:
Al alloy, Corrosion, Electrochemical, Surface modification, Marine environment키워드:
알루미늄 합금, 부식, 전기화학, 표면개질, 해양환경1. 서 론
알루미늄은 -1.66 V의 표준환원전위를 갖는 활성 금속으로써, 대기와 접하는 즉시 산소와 반응하여 10 nm 내외의 얇은 산화피막을 형성한다. 또한 이 피막은 -0.6 V의 귀전위를 나타내어 부식을 억제하는 부동태 피막으로 존재한다. 그러나 강한 부식성 환경이나 강도가 요구되는 경우에는 자연 피막보다 두꺼운 양질의 피막을 인위적으로 생성시켜 특성을 개선하고 있다. 그 중 전해액을 이용한 표면개질에 의해 형성되는 피막은 크게 다공성 산화피막(porous oxide film)과 장벽형 산화피막(barrier oxide film)으로 구분된다. 일반적으로 산화피막은 비정질(amorphous) 구조이고, 밀도는 3.0 g/cm3, 그리고 열전도율은 0.07 cal/cm∙sec∙℃ 정도로 단열성이 우수한 특징이 있다[1]. 특히 산성(황산[2], 인산[3], 수산[4], 크롬산 등) 전해액 내에서는 초기 생성된 산화피막의 용해반응으로 인해 다공층 구조가 형성된다. 이렇게 형성된 기공(pore)의 특성은 처리공정에 따라 조절 가능하며, 특히 두 단계의 표면개질 공정을 거쳐 형성된 다공 구조의 경우 기공 크기가 균일하고 배열이 매우 규칙적인 특징이 있다[5]. 또한 알루미늄 산화피막의 기공 내에는 미세 기공이 존재하고, 이는 소지금속의 표면까지 확장되어 있어 밀봉(sealing)을 통한 후처리 시 보다 우수한 특성을 갖는다[3]. 이러한 산화층은 탁월한 내식성, 내마모성, 그리고 기공을 이용한 채색성 등으로 여러 분야에 이용되고 있다. 따라서 본 연구에서는 해양환경에 노출된 알루미늄 합금의 내식성 개선을 위해 전해액 온도 변화에 따른 표면개질을 실시하여 전기화학적 특성을 평가하였다.
2. 실험방법
본 연구에서는 균일한 다공성 피막 제조를 위해 에탄올(Ethanol, 95 %)과 과염소산(Perchloric acid, 70 %)을 4:1(v/v)의 비율로 혼합한 용액을 사용하여 25 V, 5 ℃ 조건에서 3분간 전해연마(electro-polishing)하였다. 이후 황산을 전해액으로 1단계 표면개질을 실시하였으며, 이중 비이커를 이용해 전해액의 온도를 5 ℃ ~ 20 ℃까지 각 조건별로 일정하게 유지하였다. 또한 전해액 농도와 공정시간은 각각 10 vol.%와 40분으로 고정하였다. 양극은 두께가 5 mm이고 크기가 2 cm × 2 cm인 5083-O 알루미늄 합금을, 음극은 백금전극을 사용하여 극간 거리를 3 cm로 일정하게 유지하였다. 실험 시 국부적인 온도 상승으로 안정된 산화층 성장이 방해되는 것을 억제하기 위해 일정 속도로 교반하였으며, 정전류 방식을 사용하여 전류밀도를 20 mA/cm2로 유지하였다. 이후 1단계 표면개질에서 생성된 불규칙한 산화피막을 제거하고 2단계 표면개질 공정(1단계와 동일) 진행을 위해 크롬산(Chromic acid, 1.8 wt.%)과 인산(Phosphoric acid, 6 wt.%)의 혼합용액으로 60 ℃ 온도에서 30분간 에칭을 실시하였다. 또한 표면개질 후 전계방출 주사전자 현미경(field emission scanning electron microscope, FE-SEM)으로 피막 기공을 관찰하였으며, 에너지 분산형 분광기(energy dispersive spectroscopy, EDS)를 통해 표면 조성을 분석하였다. 양극분극 실험은 개로전위에서 +3.0 V까지 2 mV/s의 주사속도로 천연해수에서 실시하였으며, 손상거동 관찰을 위해 3D 분석 현미경을 사용하여 표면 형상을 비교하였다. 또한 부식전위와 부식전류밀도 측정을 위해 동일 해수에서 개로전위를 기준으로 ±0.25 V 분극시켜 타펠 분석을 실시하였다. Table 1은 사용된 재료의 화학 조성 및 세부 실험 조건을 나타낸 표이다.
3. 실험결과 및 고찰
Figure 1은 전해액 농도와 공정시간이 각각 10 vol.%, 40분이고, 적용 전류밀도가 20 mA/cm2인 조건에서 전해액 온도변화에 따른 표면개질 후 표면 형상을 관찰한 것이다. 알루미늄 산화피막은 소지금속과 피막 사이에 형성되는 장벽층(barrier layer)과, 전해액과의 접촉면에 형성되는 다공층(porous layer)으로 구성된다. 장벽층은 기공이 없고 치밀한 막으로 적용 전압에 비례하여 일정 두께를 유지하는 반면, 다공층은 전해액과의 전기화학적 용해반응으로 내부에 기공을 가지는 원주형 관(tube)을 형성한다[3]. 이 다공층은 용해력을 가진 전해액에서 생성되는데, 동일한 전해액이라도 반응 온도에 따라 특성이 달라진다. 실험 결과, 전해액 온도 5 ℃에서는 일부 표면에서 불완전한 기공의 형성이 관찰되었다. 반면 전해액 온도 10 ℃와 15 ℃에서는 알루미늄 산화피막 특유의 육각형(hexagonal) 구조가 비교적 선명하고 장벽층 또한 양호하게 형성되었다. 또한 전해액 온도 20 ℃에서는 10 ℃와 15 ℃에 비해 작은 기공과 함께 다소 불규칙한 구조가 관찰되었다. 특히 전해액 온도 5 ℃를 제외한 모든 조건에서 기공 내에 존재하는 미세 기공이 소지금속의 표면까지 확장되어 있음을 알 수 있다[3]. 이는 표면개질 공정에서 생성된 산화물이 우선적으로 용해된 부분으로, 이곳을 통해 전류가 흐르면서 나노튜브(nano tube)가 성장하게 된다. 일반적으로 전해액을 이용한 표면개질 시 피막 형성에 따른 반응열(2Al3+ + 3O2- → Al2O3 + 400 cal)로 전해액 온도가 상승하는데[6], 이러한 온도 상승은 전해액의 용해반응을 촉진시키므로 기계적 특성이 우수한 피막을 얻기 위해서는 반응열을 효과적으로 제어하거나 고온에서도 피막의 용해속도를 늦출 수 있는 전해액 개발이 요구된다. 이와 관련하여 Campbell은 -5 ℃ ~ 5 ℃의 황산 전해액에서 직류에 교류를 중첩하여 높은 피막경도를 얻는 Hardas법을 개발하였다. 또한 장 등은 전해액 온도 상승에 따른 용해속도 증가로 장벽층 두께가 현저히 얇아졌으며, 전해액 온도 –5 ℃ ~ 5 ℃의 황산 전해액에서 직류에 교류를 중첩하여 높은 피막경도를 얻는 Hardas법을 개발하였다. 또한 장 등은 전해액 온도 상승에 따른 용해속도 증가로 장벽층 두께가 현저히 얇아졌으며, 전해액 온도 0 ℃에서 매끄러운 표면과 함께 균일한 기공 직경과 분포를 가지는 알루미나 막이 형성됨을 확인하였다[7]. 그러나 본 연구의 낮은 전해액 온도(5 ℃)에서는 정상적인 기공이 형성되지 않았으며, 온도가 높아질수록 기공이 불균일하고 크기 또한 작아짐을 알 수 있다. 이와 같이 기존 연구자와 다른 결과를 나타낸 이유는 크게 두 가지로 요약된다. 첫째는 타 연구자의 소지금속이 순도 99 % 이상의 알루미늄을 사용한 반면, 본 연구에서는 산업계에서 널리 사용되는 알루미늄 합금(5083-O)을 사용하였기 때문이다. 이러한 소지금속의 함유원소 차이는 기공 형성 과정에 직접적인 영향을 미친다. 일례로 구리(Cu)는 산화피막의 전기 전도도를 증가시켜 피막 형성 전압을 낮추는 역할을 한다. 반면 실리콘(Si)은 반응에 참여하지 않고 피막에 잔존하며, 특히 전기 전도도가 매우 낮아 저항을 증가시킴으로써 높은 열을 발생시킨다[8]. 따라서 실리콘 함량이 높은 알루미늄은 용체화 처리 후 표면개질을 실시하는 것이 일반적이다[9]. 둘째로 정전압 방식이 아닌 정전류 방식을 적용하였기 때문이다. 정전압 방식은 표면개질 시 일정 전압을 유지하는 방식으로, 전해액 온도가 상승함에 따라 저항이 낮아지면서 상대적으로 흐르는 전류가 많아지게 된다. 이로 인해 전기화학적 용해반응이 활발해지면서 온도 상승에 따라 기공의 직경이 커진다. 반면 정전류 방식은 전해액 온도 상승에 따른 저항 감소로 전해전압이 낮아지면서 용해반응이 둔화되어 기공 직경이 작아진다. 결과적으로 전해액 온도 5 ℃에서는 급격한 이온의 활성도 저하와 합금 원소의 영향으로 가공이 생성되지 않았으며, 전해액 온도 20 ℃에서는 낮은 전해전압으로 인한 용해반응의 저하로 직경이 작고 불안정한 기공의 성장이 관찰된 것으로 판단된다.
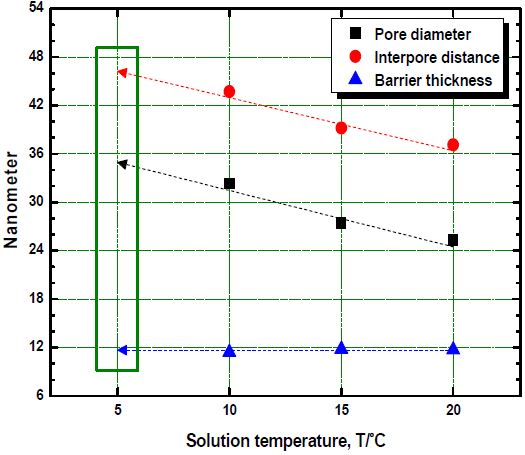
Figure 2는 전해액 농도와 공정시간이 각각 10 vol.%, 40분이고, 적용 전류밀도가 20 mA/cm2인 조건에서 전해액 온도변화에 따른 표면개질 후 기공 직경(pore diameter), 기공 사이 간격(interpore distance) 및 장벽층 두께(barrier thickness)를 측정한 것이다. 기공 직경은 전해액 온도 10 ℃에서 32.3 nm, 15 ℃에서 27.4 nm 그리고 20 ℃에서는 25.3 nm로 전해액 온도가 증가할수록 작아지는 결과를 나타냈다. 또한 전해액 온도 5 ℃에서는 정상적인 기공이 생성되지 않아 측정이 불가하였으나, 추세선을 이용하여 약 46 nm 전후 직경의 기공이 생성되었을 것으로 예상된다. 기공 사이 간격 역시 전해액 온도 10 ℃에서는 43.7 nm였으나 20 ℃에서는 37.1 nm로 감소하였다. 이는 전해액 온도가 증가할수록 전해전압이 낮아지면서 용해반응이 둔화되어 기공 직경 감소와 함께 기공 간격 역시 감소하면서 두 값의 차이인 장벽층 두께가 거의 유사한 값을 나타낸 것으로 판단된다.
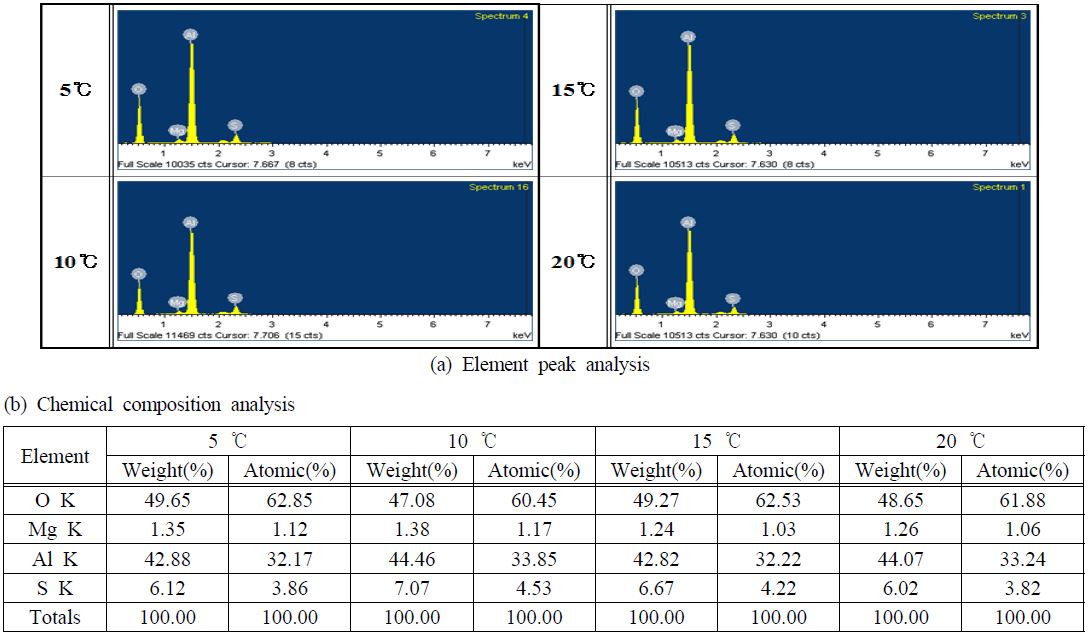
Figure 3은 전해액 농도와 공정시간이 각각 10 vol.%, 40분이고, 적용 전류밀도가 20 mA/cm2인 조건에서 전해액 온도변화에 따른 표면개질 후 표면 조성 관찰을 위한 에너지 분산형 분광기(EDS) 분석 결과를 나타낸 것이다. 4가지 조건 모두 알루미늄(Al)과 산소(O)가 주성분이며, 그 외 미량의 마그네슘(Mg)과 황(S)이 검출되었다. 이는 사용된 소지금속(5083-O)에 소량의 마그네슘(6.42 wt.%)이 포함되어 있고 황산을 전해액으로 사용하여 장벽층에 혼입되어 있던 가 검출된 것으로 판단된다. 따라서 표면개질을 실시한 경우에는 표면에 알루미늄과 산소 그리고 마그네슘이 존재하는 것을 알 수 있으며, 이로 인해 표면에알루미늄 산화막(aluminum oxide film)이 형성되었음을 유추해볼 수 있다. 또한 산소/알루미늄 원자량 비는 전해액 온도 5 ℃에서 1.95, 10 ℃에서 1.78, 15 ℃에서 1.94 그리고 20 ℃에서는 1.86을 나타냈다. 스펙트럼의 가로축은 X-선 에너지, 그리고 세로축은 해당 X-선의 상대적 강도를 나타낸다. 그러나 X-선의 세기는 동일한 양으로 존재하더라도 역학 에너지에 따른 흡수정도의 차이로 서로 다르게 나타난다. 따라서 알루미나(Al2O3)의 경우 산소/알루미늄 원자비가 이론적으로 1.5가 되어야 하지만 실제 측정에서는 그렇지 않다. 이는 사용된 재료가 순수 알루미늄이 아니고, 최근 연구에 의해 알루미늄 산화피막이 Al2O3 : 64 %, Al(OH)3 : 27 %, Al : 9 %로 구성되어 있음을 X선 광전자 분광법(X-ray photoelectron spectroscopy, XPS)으로 확인된 바가 있다[10]. 또한 Chang 역시 결정질(crystalline) 알루미나의 경우 이론적 비율(stoichiometric ratio)인 1.5에 근접하게 나타나지만, 비정질 알루미나의 경우 이보다 훨씬 높게 나타나며, 이로 인해 결정질 알루미나가 산소 과잉(oxygen-rich) 비정질 알루미나로부터 생성된다고 밝혔다[11]. 결과적으로 전해액 온도에 따른 반응성 및 전해전압의 차이와, 과잉 공급된 산소에 의해 장벽층을 구성하는 성분에 차이가 발생했으나, 온도차가 적고 공정시간이 길지 않아 거의 유사한 함량(알루미늄 : 32.17 ~ 33.85 at.%, 산소 : 60.45 ~ 62.85 at.%)이 검출된 것으로 판단된다.
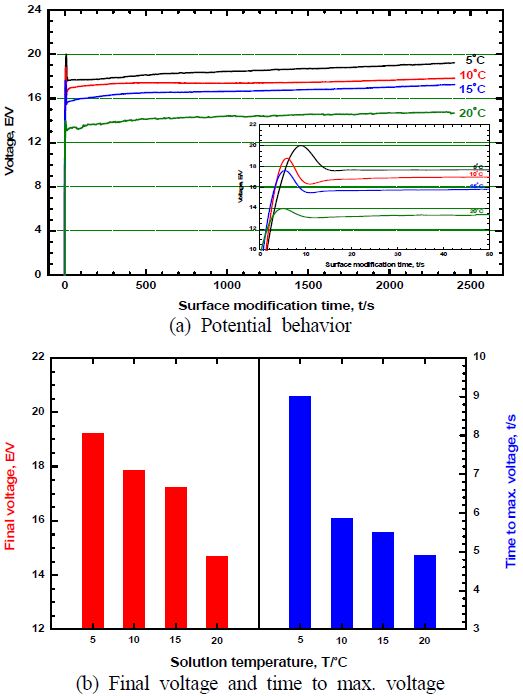
Figure 4는 전해액 농도와 공정시간이 각각 10 vol.%, 40분이고, 적용 전류밀도가 20 mA/cm2인 조건에서 전해액 온도변화에 따른 표면개질 시 전압측정 결과를 나타낸 것이다. Figure 4 (a)의 전압거동 관찰 결과, 시간경과에 따라 전해전압이 초기에는 급격히 증가하다가 다시 감소한 후 일정하게 유지됨을 알 수 있다. 이는 알루미늄 표면에 치밀한 알루미나 막이 형성되면서 저항 증가에 따른 전압 상승으로 판단된다. 이후 전압이 감소하였는데, 이는 특정 부위에 전류가 집중되면서 알루미나 막이 용해되어 증가된 전류량에 의해 전압이 감소한 것으로 판단된다. 이후 일정한 밀도를 갖는 기공이 생성되고 음이온과 양이온의 이동이 원활해져 알루미나의 형성이 안정되면서 전해전압이 일정하게 유지된 것으로 판단된다[12]. 후반부로 갈수록 전해전압이 조금씩 증가하였는데, 이는 산화반응이 진전되면서 다공층 피막 두께가 증가하는 것을 의미한다. 또한 Figure 4 (b)에서 비교한 바와 같이 전해액 온도가 높아질수록 최종 전해전압이 5 ℃에서의 19.2 V보다 낮은 17.8 V(10 ℃), 17.2 V(15 ℃) 그리고 14.6 V(20 ℃)를 나타냈다. 전해 전압이 높다는 것은 그만큼 산화피막 생성에 필요한 에너지의 소모가 많다는 것을 의미한다. 따라서 높은 전해전압은 표면의 온도상승을 유발하여 전기화학적 용해작용을 가속시켜 기공 직경을 크게 한다. 이러한 전해전압은 피막 형성에 영향을 주는 전해액의 농도 및 온도, 전류밀도, 교반속도 등에 좌우된다. 본 연구에서는 20 mA/cm2의 전류밀도를 유지하기 위한 전해전압이 전해액의 온도가 증가함에 따라 감소함을 보여준다. 반면 전해액 온도가 증가하면 용해력이 증대되어 초기에 형성되는 장벽층이 상대적으로 얇아져 기공이 쉽게 생성됨으로써 낮은 전해전압을 나타낸 것으로 판단된다. 따라서 전해액 온도가 증가할수록 더 많은 기공을 빠른 시간에 형성할 수 있으며, Figure 2에서도 알 수 있듯이 기공 직경이 전해전압의 크기에 비례한다는 이론과도 일치한다[13]. 동일한 원리로 최대 전해전압 도달시간은 전해액 온도 5 ℃에서 9.01초, 10 ℃에서 5.87초, 15 ℃에서 5.51초 그리고 20 ℃에서 4.91초로 단축되었다.
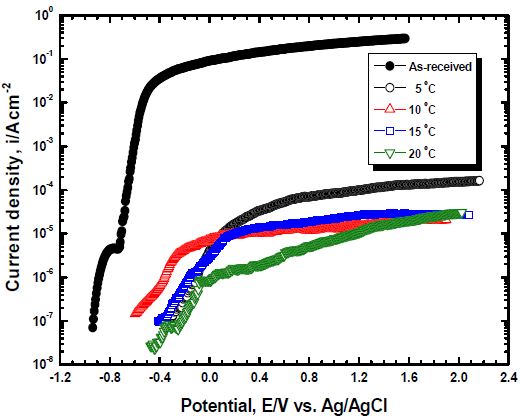
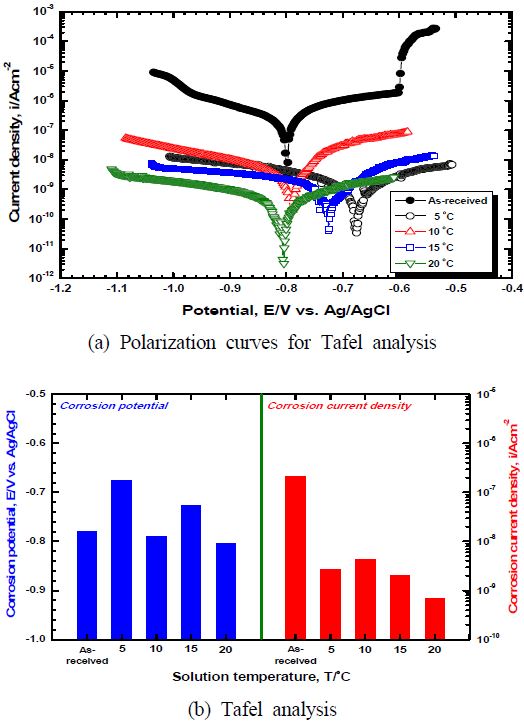
Figure 5는 전해액 농도와 공정시간이 각각 10 vol.%, 40분이고, 적용 전류밀도가 20 mA/cm2인 조건에서 전해액 온도 변화에 따른 표면개질 후 양극 분극 실험 결과를 비교한 그래프이다. 대체적으로 실험 시작부터 종료 시까지 표면개질을 실시한 경우가 표면개질을 실시하지 않은 경우에 비해 전 영역에서 현저히 낮은 전류밀도 값을 나타냈다. 표면개질을 실시하지 않은 경우 개로전위에서 전위 증가에 따라 4.61×10-6 A/cm2까지 상승한 후 증가폭이 일시적으로 감소하는 경향이 관찰되었다. 이후 공식(pitting) 발생으로 급격한 전류밀도 상승이 관찰되었으며[14], 이는 해수 속에 포함되어 있는 염소이온(Cl-)에 의해 부동태 피막이 파괴되면서 공식이 발생하고 지속적인 활성용해반응에 의해 발생된 산소 및 입계 탈리현상에 의해 부식생성물이 제거되면서 전류밀도가 꾸준히 증가한 것으로 판단된다[15]. 이와 같이 양극 분극 거동에서 낮은 전류밀도를 나타내는 경향이 관찰되는 것은 산화반응에 의해 형성된 부식생성물이 전하의 이동을 방해하기 때문이다[16]. 반면 표면개질을 실시한 경우 완만한 부동태 구간이 관찰되었으며 실험 종료 시까지 꾸준한 전류밀도의 상승이 관찰되었으며, 그 값은 매우 낮았다. 알루미늄은 대기 또는 수중에서 산화과정을 거쳐 알루미나를 형성하여 소지금속을 보호하는 것으로 알려져 있다[16]. 이와 같이 우수한 내식성에도 불구하고 염소이온에 의해 국부 부식이 발생하면서 공식이 생성되기도 한다. 그러나 표면개질에 의해 생성된 알루미나는 자연적으로 생성된 부동태 피막에 비해 화학적 안정성이 높고 두껍기 때문에 실험 종료 시까지 낮은 전류밀도를 나타낸 것으로 판단된다. 특히 전해액 온도 5 ℃에서는 다른 표면개질 조건에 비해 높은 전류밀도를 나타냈는데, 이는 급격한 이온의 활성도 저하와 합금 원소의 영향으로 정상적인 기공이 생성되지 않아 소지금속의 영향을 크게 받았기 때문으로 판단된다. 또한 전해액 온도 20 ℃에서는 낮은 전해전압으로 인한 용해반응의 저하로 직경이 작은 기공과 함께 우수한 환경차단 및 절연 특성을 나타내어 낮은 전류밀도가 측정된 것으로 판단된다.
Figure 6은 전해액 농도와 공정시간이 각각 10 vol.%, 40분이고, 적용 전류밀도가 20 mA/cm2인 조건에서 전해액 온도변화에 따라 표면개질된 시편의 양극 분극 실험 후 3D 분석 결과를 나타낸 것이다. 표면개질을 실시하지 않은 경우에는 지속적인 활성용해반응으로 인한 부식과 탈리현상으로 표면에 큰 손상이 관찰되었다. 알루미늄의 경우 양극 분극 초기에 산화반응에 의한 피막 형성으로 전하의 이동을 방해하기 때문에 낮은 전류밀도를 나타내는 구간이 관찰된다. 그러나 지속적인 활성용해반응으로 인해 산화물이 제거되면서 국부 영역에서 115.2 ㎛ 깊이의 공식이 관찰되었다. 또한 자기증식(self-propagating) 메커니즘[17]으로 인해 표면에서 발생한 손상부위에서 급속한 용해반응으로 양전하가 과도하게 많아지므로 반응이 촉진된다. 반면 표면개질을 실시한 경우 전해액 온도 10 ℃ ~ 20 ℃에서는 4.9 ㎛ ~ 6.6 ㎛ 범위의 극히 적은 손상깊이를 나타낸 반면, 전해액 온도 5 ℃에서는 요철과 함께 11.8 ㎛의 상대적으로 큰 손상깊이가 관찰되었다. 이는 급격한 이온의 활성도 저하와 합금 원소의 영향으로 기공 생성이 불완전하여 용해반응이 일어나면서 다른 조건보다 큰 손상이 발생한 것으로 판단된다. 따라서 표면에 생성된 알루미나에 의해 표면개질 유무에 따른 손상량에 큰 차이가 발생했으며, 표면개질을 실시한 경우에도 전해액 온도에 따라 생성된 피막의 건전성 차이로 인해 손상량의 차이가 관찰되었다. 그러나 전기절연성이 높고, 내마모성 및 화학적 안정성이 우수한 알루미나가 전하의 이동을 방해하면서 전체적으로 우수한 전기화학적 특성을 나타냈다.
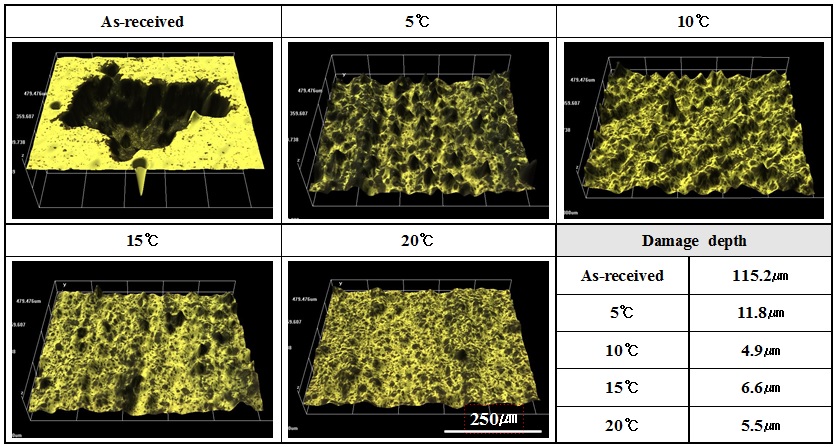
Comparison of 3D analysis and damage depth after anodic polarization experiment for surface modified specimen with solution temperature
Figure 7은 전해액 농도와 공정시간이 각각 10 vol.%, 40분이고, 적용 전류밀도가 20 mA/cm2인 조건에서 전해액 온도변화에 따른 표면개질 실시 후 타펠 분석 결과를 나타낸 것이다. 표면개질을 실시하지 않은 경우, 음극 분극 곡선에서 농도분극현상이 관찰되었으며, 전위가 비방향으로 이행하면서 전류밀도가 증가하는 경향을 나타냈다. 또한 양극분극 곡선에서 전위 증가에 따라 완만하게 전류밀도가 상승하다 -0.601 V에서 공식발생으로 인해 전류밀도가 급격히 상승하는 경향이 관찰되었다. 반면 표면개질을 실시한 경우에는 양극분극과 음극분극이 진행되어 개로전위로부터 전위차가 커지면서 완만한 전류밀도의 상승이 관찰되었다. 표면개질을 실시한 경우 표면에 생성된 산화물이 알루미나로 동일하고, 개로전위를 기준으로 양극분극과 음극분극 시키는 정도가 적어 유사한 분극 경향을 나타냈으며, 표면개질을 실시하지 않은 경우에 비해 안정적이고 낮은 전류밀도를 나타낸 것으로 판단된다. 부식전위 측정 결과, 가장 귀한 부식전위를 나타낸 전해액 온도 5℃의 경우가 전기화학적으로 가장 안정하고, 가장 낮은 부식전위를 나타낸 20℃가 가장 열악하다고 할 수 있다. 그러나 부식전위는 갈바닉 셀 형성 시 영향을 주는 인자로써 전해액 온도 5℃가 전기화학적으로 가장 안정하다는 것 외에 특별한 의미는 없다. 일반적으로 중성용액에서의 부식전위는 용존산소 확산에 따른 농도분극과 양극의 산화반응에 따른 활성화 분극에 의해서 형성되며, 부식속도를 구할 경우 분극곡선상의 확산한계전류밀도를 부식전류밀도로 가정한다. 부식전류밀도 비교 결과, 표면개질을 실시하지 않은 경우 2.09 × 10-7 A/cm2의 높은 부식전류밀도를 나타낸 반면, 표면개질을 실시한 경우에는 전해액 온도 5 ℃, 10 ℃, 15 ℃ 그리고 20 ℃의 경우 각각 2.74 × 10-9 A/cm2, 4.19 × 10-9 A/cm2, 2.05 × 10-9 A/cm2, 6.88 × 10-10 A/cm2로 매우 낮은 값을 나타내어 해수에서의 내식성이 현저히 향상된 것으로 판단된다. 대체적으로 부식전류밀도는 표면에 불완전 기공이 생성된 전해액 온도 5 ℃를 제외하고 전해액 온도가 증가함에 따라 지속적으로 감소하는 결과를 나타냈다. 이는 전해액 온도 증가에 따라 기공율이 감소하면서 장벽층을 형성하는 알루미나의 면적이 상대적으로 증가하였기 때문으로 판단된다.
4. 결 론
본 연구에서는 해양환경에서 우수한 내식성을 보유할 수 있는 최적의 표면개질 전해액 온도를 선정하고자 전기화학 실험을 실시하였다. 표면관찰 결과 5 ℃에서는 급격한 이온의 활성도 저하와 합금 원소의 영향으로 기공이 생성되지 않았으며, 20 ℃에서는 낮은 전해전압으로 인한 용해반응의 저하로 직경이 작고 불안정한 기공의 성장이 관찰되었다. 또한 표면개질을 실시한 경우가 현저히 낮은 부식전류밀도를 나타냈으며, 특히 불완전 기공이 생성된 5 ℃를 제외하고 전해액 온도가 증가함에 따라 감소하는 결과를 나타냈다. 따라서 우수한 피막 정렬도와 낮은 부식 전류밀도를 나타낸 15 ℃가 최적의 전해액 온도 조건으로 판단된다.
Acknowledgments
이 논문은 2014년 해양수산부 재원으로 한국해양과학기술진흥원의 지원을 받아 수행된 연구임(무도장, 유지보수 프리 친환경 알루미늄 선박 건조).
References
-
M. S. Hunter, and P. Fowle, “Determination of barrier layer thickness of anodic oxide coatings”, Journal of the Electrochemical Society, 101(9), p481-485, (1954).
[https://doi.org/10.1149/1.2781304]

-
J. E. Lewis, and R. C. Plumb, “Studies of the anodic behavior of aluminum”, Journal of the Electrochemical Society, 105(9), p498-502, (1958).
[https://doi.org/10.1149/1.2428908]

-
F. Keller, M. S. Hunter, and D. L. Robinson, “Structural features of oxide coatings on aluminum”, Journal of the Electrochemical Society, 100(9), p411-419, (1953).
[https://doi.org/10.1149/1.2781142]

-
K. N. Rai, and E. Ruckenstein, “Alumina substrates with cylindrical parallel pores”, Journal of Catalysis, 40(1), p117-123, (1975).
[https://doi.org/10.1016/0021-9517(75)90234-1]

-
H. Masuda, and K. Fukuda, “Ordered metal nanohole arrays made by a two-step replication of honeycomb structures of anodic alumina”, Science, 268(5216), p1466-1468, (1995).
[https://doi.org/10.1126/science.268.5216.1466]

- K. T. Kim, M. K. Ahn, J. H. Lee, and H. S. Kwon, “Effects of silicone contents and flow rates on the formation and mechanical properties of hard anodized film of Al-Si alloys”, Journal of the Korean Institute of Surface Engineering, 24(4), p179-186, (1991).
- Y. H. Chang, C. W. Lee, and Y. M. Hahm, “Preparation of porous alumina membrane by anodic oxidation in sulfuric acid”, Journal of the Korean Institute of Chemical Engineers>Journal of the Korean Institute of Chemical Engineers, 36(5), p653-660, (1998).
- J. W. Moon, J. H. Lee, and H. S. Kwon, “A study on the characteristics of hard anodizing film of Al-Si piston alloy”, Journal of the Korean Institute of Surface Engineering, 23(1), p34-43, (1990).
- G. William, Wood, Metals handbook, vol. 5, Surface Cleaning, Finishing, and Coating, 9th Edition, American Society for Metals, Ohio, (1982).
-
D. Chen, K. J. Howe, J. Dallman, and B. C. Letellier, “Corrosion of aluminium in the aqueous chemical environment of a loss-of-coolant accident at a nuclear power plant”, Corrosion Science, 50(4), p1046-1057, (2008).
[https://doi.org/10.1016/j.corsci.2007.11.034]

-
J. K. Chang, C. M. Liao, C. H. Chen, and W. T. Tsaia, “Microstructure and electrochemical characteristics of aluminum anodized film formed in ammonium adipate solution”, Journal of The Electrochemical Society, 150(6), p266-273, (2003).
[https://doi.org/10.1149/1.1570822]

- Y. S. Jeong, The Structural Chemistry of Anodic Alumina, Ph. D. Thesis, Corrosion and Protection Centre, The University of Manchester Institute of Science and Technology, UK, (1993).
-
T. P. Hoar, and J. Yahalom, “The initiation of pores in anodic oxide films formed on aluminum in acid solutions”, Journal of the Electrochemical Society, 110(6), p614-621, (1963).
[https://doi.org/10.1149/1.2425839]

-
R. T. Foley, “Localized corrosion of alumium alloys - A Review”, Corrosion, 42, p277-288, (1986).
[https://doi.org/10.5006/1.3584905]

-
Y. Zheng, S. Luo, and W. Ke, “Effect of passivity on electrochemical corrosion behavior of alloys during cavitation in aqueous solutions”, Wear, 262(11-12), p1308-1314, (2007).
[https://doi.org/10.1016/j.wear.2007.01.006]

- M. Pourbaix, Atlas of Electrochemical Equilibria, ed. by J. A. Franklin, National Association of Corrosion Engineers, Houston, (1974).
- Denny A. Jones, Principles and Prevention of Corrosion, 2nd Edition, Prentice Hall, Pearson, (1996).