650 ℃의 N2-O2-CO2가스환경 하에서 Fe-1.5Cr-0.5Mo 강의 산화 및 기계적 물성치에 미치는 KCl 침적의 영향
Copyright © The Korean Society of Marine Engineering
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0), which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
초록
본 연구에서는 표면 KCl 침적에 의한 Fe-1.5Cr-0.5Mo 강의 산화 및 강도저하를 평가하기 위해 650 ℃의 N2-10%O2-10%CO2 가스환경 하에서 등온산화실험을 실시하였다. 산화특성은 무게 증가량, 주사전자현미경, 에너지 분산형 X선 분광기를 이용하여 실시하였으며, 표면 산화에 따른 강도저하 평가는 인장실험을 통해 실시하였다. KCl에 침적된 시편에서는 미 침적 시편 대비 Fe2O3/ Fe3O4/ FeO 구조를 가진 다공성의 산화층이 약 3배 이상 두껍게 형성되었다. 인장 및 항복강도는 산화물 형성에 기인한 단면적 감소에 비례하여 저하되는 경향을 나타냈다.
Abstract
In this study, an isothermal oxidation experiment was conducted to investigate the effect of KCl deposition on the oxidation and strength degradation characteristics of Fe-1.5Cr-0.5Mo steel in N2-10%O2-10%CO2 gas environment at 650 °C. The oxidation properties were characterized by weight gain, scanning electron microscopy, and energy dispersive X-ray spectroscopy. The strength degradation by surface oxidation was evaluated via a tensile test. In the specimens with deposited KCl, a porous oxide layer with the Fe2O3/ Fe3O4/ FeO structure was formed, and was approximately thrice thicker than the un-deposited specimens. The tensile and yield strengths showed a tendency to decrease in proportion to the reduction in cross-sectional area due to the formation of the oxide.
Keywords:
Fe‐1.25Cr‐0.5Mo, KCl deposition, High-temperature oxidation, Strength degradation키워드:
Fe‐1.25Cr‐0.5Mo, KCl 침적, 고온산화, 강도저하1. 서론
크롬(Cr)과 몰리브덴(Mo)을 함유하는 페라이트계 강은 높은 고온강도, 크리프 저항성, 우수한 열 전도성, 용접성, 그리고 내식성을 가진 강종이다[1]. 이와 같은 장점 때문에 페라이트계 강은 선박 및 발전설비의 증기발생기 및 수냉벽에 대한 소재로 적용되고 있다. 그 중 크롬 함량이 상대적으로 낮은 저합금강은 저렴한 비용으로 인해 해양, 발전, 그리고 화학 등의 다양한 산업 분야에 적용되고 있다. 그러나 저합금강은 마르텐사이트강, 오스테나이트 스테인리스강, 그리고 니켈 초합금과 같은 고 내식성강에 비해 부식손상에 취약할 수밖에 없다[2]. 고온설비의 경우, 연소가스의 가혹한 환경에 장시간 노출됨에 따라 부식손상이 발생하며, 이에 따른 내구성 저하는 설비의 안정성 및 수명을 감소시킨다. 더욱이 고온설비는 접근이 수월하지 않아 수리와 교환에 경제적 및 인적 비용손실이 크게 발생한다.
선박의 경우 메인 보일러, 보조 보일러, 증기터빈, 그리고 소각기 등의 다양한 고온설비 등이 장착되어 있으며, 다양한 저합금강이 적용되고 있다.
선박이 운항하는 해양은 습도가 높고 염분이 많은 환경이며[3], 대기 중에 다량의 염화물 입자와 수증기가 존재한다[4][5]. 고체 염화물과 수분의 시너지 효과는 금속 재료의 부식을 가속화시키며, 해양환경 하에서 부식 연구는 오랜 기간 진행되어 왔다[6][7]. 해양 대기에 포함된 다량의 염화물(NaCl, KCl)은 흡입 공기와 함께 에어로졸(Aerosol) 형태로 보일러, 가스터빈 등의 연소장치에 공급된다. 흡입된 염화물은 금속표면에 융착되며, 고온의 연소가스와 반응하여 염화물 부식(Chlorine corrosion), 알칼리 부식(Alkali corrosion), 용융염 부식(Molten-salt corrosion) 기구를 통해 금속의 보호적인 산화피막을 파괴시킬 뿐만 아니라, 휘발성의 금속염화물을 형성하여 스케일/금속계면에서의 부식을 가속화시킨다[8].
더욱이, 국제적인 대기오염 문제로 인해 화석 연료를 대체할 수 있는 바이오매스(Biomass)에 대한 관심이 고조되고 있다. 국내에서도 바이오매스 발전소가 중유와 석탄 등 화석연료를 대체하고, CO2를 줄이기 위한 신재생에너지 발전소로서 운영되고 있다. 그러나 바이오매스는 연소 시 나트륨(Na), 칼륨(K) 및 염화물(Cl)을 다량으로 배출한다[9]. 연소가스와 함께 배출된 다량의 염화물은 과열기(Superheater) 전열관 등에 용착되어 심각한 부식문제를 일으키며, 유지/관리 비용을 크게 증가시킨다. 또한, 온도에 매우 민감하여 설비의 고 효율화를 위한 증기온도 상승을 제한시킨다. 따라서 바이오매스 발전 시에는 염화물에 따라 발생하는 염소가스에 의한 부식 문제 최소화에 많은 관심이 집중되고 있다. 특히, 고온 설비에 있어 전열관은 그 온도가 최대 1200 ℃에 이르기 때문에 알칼리 부식에 있어 가장 취약한 환경으로 고려된다.
따라서 본 연구에서는 과열기 전열관 소재인 저합금강 Fe-1.25Cr-0.5Mo을 선정하여, 연소가스 환경 하에서 염화물(KCl)의 표면 침적에 따른 산화현상과 그에 따른 기계적 강도 저하 거동을 평가하였다.
2. 실험방법
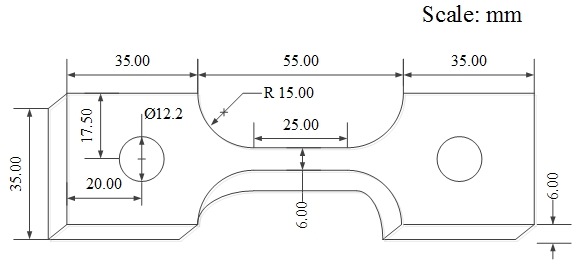
본 실험에서 사용된 Fe-1.25Cr-0.5Mo 강의 화학성분 (wt.%)은 0.13 C, 0.56 Si, 0.55 Mn, 1.34 Cr, 0.6 Mo, 그리고 나머지는 Fe 이다. 각 강판을 일정 크기로 절단 후 기계적 특성 평가를 위한 6 mm 폭과 25 mm 표점거리의 평행부를 가진 Figure 1의 인장시험편과 표면 산화 특성 평가를 위한 10 mm × 10 mm × 6 mm 크기의 미소시험편을 가공하였다. 시험편의 전처리는 에머리 페이퍼 # 1,200번까지 연마 후 에탄올 및 증류수에서 초음파 세척 하였으며, 진공건조기에 보관 후 사용하였다. KCl 침적은 에탄올+KCl(s) 슬러리를 균일하게 시편에 분사하였으며, 분사 및 건조 과정을 총 3회 반복하였다. 등온산화 실험에 대한 온도선정은 선박용 주 보일러 증기온도(520 ℃)[10], 연소가스에 의한 열 플럭스[11], 그리고 재료의 한계온도[12] 등을 고려하여 650 ℃로 선정하였다. 등온산화 실험은 전 처리된 미소 시험편을 전기 열처리로에 장입 후 650 ℃까지 승온하였으며, 1기압의 대기와 50 cc/min의 유량을 가진 N2 + 10%O2 + 10%CO2 가스환경[9] 하에서 실시하였다. 산화시험 후 급격한 냉각에 의한 산화층의 박리를 최소화하기 위해 노냉을 실시하였다. 산화특성은 주사전자현미경(Scanning Electron Microscopy, SEM), 에너지 분산형 분광 분석기(Energy Dispersive Spectroscopy, EDS)를 통해 실시하였다. 산화속도 측정을 위한 무게증가량은 0.1 mg의 정밀도를 가진 전자저울을 사용하였다. 무게증가량 데이터에 대한 신뢰성 확보를 위해 최소 동일 조건에 대하여 3회 이상 측정 후 그 평균값을 산출하였다. 인장시험은 상온에서 2 mm/min의 변위제어를 통해 실시하였으며, 항복점은 0.2 % 오프셋(Off-set)을 통해 산출하였다.
3. 결과 및 고찰
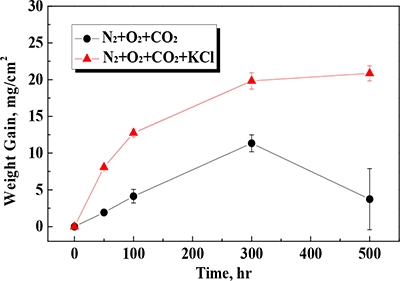
Figure 2는 650℃의 N2-O2-CO2-KCI(s) 가스환경에서 산화된 Fe-1.25Cr-0.5Mo 시험편의 단위면적당 무게 증가량을 시간에 따라 나타낸 것이다. KCl 침적 여부에 상관없이 무게증가량은 300시간까지 급격하게 증가하는 유사한 산화거동을 나타냈다. 그러나 KCl 침적 여부에 따른 무게증가량은 큰 차이를 나타냈다. KCl에 첨가된 시험편에서는 미 침적 시험편 대비 약 3.0배 이상의 큰 무게증가량을 나타냈다. 특히, 그 차이는 50시간에서 약 4.0배로 가장 크게 나타났다. 실험 초기 큰 무게 증가량의 차이를 나타낸 원인은 다음과 같다. 먼저, 알칼리 염화물에 침적된 금속재료의 부식성은 알칼리 염화물이 산소와 결합하여 스케일 표면에 금속 염화물을 형성하는 ‘활성 산화(Active oxidation)’ 메커니즘에 기인한다. 다음으로 알칼리 염화물에 의한 활성 산화는 실험 초기에 강하게 나타나며, 시간 경과에 따라 그 효과는 감소된다. 이처럼 산화환경 하에서 시간 경과에 따른 알칼리 염화물에 의한 활성산화 효과 감소는 사전문헌에서 이미 확인된 바가 있다[13]. 무게 증가량은 초기 50시간에서 가장 큰 차이를 나타낸 이후, 100시간부터는 상호 비슷한 경향을 나타냈다. 500시간에서 미 침적 시편의 무게증가량 감소는 실험 및 냉각과정에서 모재와 접착력이 약한 산화층의 박리에 기인한 것으로 판단된다.
Figure 3은 650℃의 N2-O2-CO2-KCl(s) 가스환경에서 산화된 Fe-1.25Cr-0.5Mo 시편의 단면을 광학현미경으로 관찰한 것이다. 전반적인 산화층은 외부층과 내부층으로 이루어진 다층 구조의 형상을 나타냈다. 외부층에서 관찰되는 다수의 기공과 균열은 양이온의 외부확산에 기인한 커캔달(Kirkendall) 기공, 산화물과 기지간의 상이한 열팽창계수, 그리고 냉각과정에서 발생한 응력 등의 복합적인 요인이 작용하여 생성된 물리적 결함이다[14]. 특히, KCI에 침적된 시험편에서 산화층 내부의 기공 및 결함이 미 침적 시험편과 비교하여 증가하는 경향을 나타냈다. 이는 저 융점의 금속염화물이 휘발되는 과정에서 다공성의 비보호적인 산화막이 빠르게 형성되기 때문이다[15][16]. 미 침적 시험편 대비 다공성의 산화막이 두껍게 형성되었다. 500시간에서 KCI 침적 여부에 따른 산화층의 두께는 각각 81.2 μm와 262.8 μm로, KCl에 침적된 시편에서 약 3.2배의 두꺼운 산화층이 형성되었다. 또한, 이는 앞선 Figure 2의 무게증가량과 일치하는 경향이다.
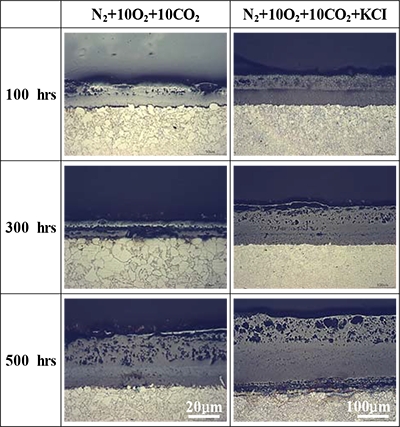
Cross-section of oxide layer for the Fe-1.25Cr-0.5Mo steel in the N2-O2-CO2-KCl(s) gas environment at 650 ℃
Figure 4는 650℃의 N2-O2-CO2 가스환경에서 산화된 Fe-1.25Cr-0.5Mo 시험편의 산화층 단면에 대한 EDS 원소분포도를 나타낸 것이다. 일반적인 산화환경에서 Fe은 상대적으로 얇은 적철광(Hematite)와 자철석(Magnetite) 층을 형성한다[17]. 본 연구에서도 Fe-1.25Cr-0.5Mo 강은 다공성의 외부층과 내부층으로 이루어진 Fe-산화층을 형성하였다. EDS 원소 분포도에 따라 외부층은 Fe2O3와 Fe3O4가 공존하는 산화층이며, Fe 분포도에서 나타난 내/외부 산화층의 농도 구배는 Fe가 외방 확산함에 따라 나타난 것이다[18][19]. 또한, 내부층의 주 원소는 Fe, Cr, 그리고 O이며, 산화결정상은 FeO로 판단된다[17]. FeO 내부층의 빈 공간은 모재와의 결합력이 약한 Fe-산화층 일부가 시편의 냉각 및 시편 전처리과정에서 탈리된 것으로 사료된다. 일반적으로 Fe-Cr 계열의 합금은 고온 산화 시 Cr 함량에 따라 Fe2O3외부층, Fe3O4 중간층, 그리고 FeO 내부층으로 이루어진 3층 구조의 산화층을 형성하거나, Fe2O3 외부층과 Cr2O3 및(Fe, Cr)3O4가 혼재된 내부층으로 이루어진 2층 구조의 산화층을 형성한다[17]. 그러나 Fe-1.25Cr-0.5Mo 강의 경우, Cr 함량이 1.34 %로 매우 낮기 때문에 (Fe, Cr)3O4 스피넬(Spinel) 층은 관찰되지 않았다.

SEM image and EDS element map for the Fe-1.25Cr-0.5Mo steel in the N2-O2-CO2 gas environment at 650 ℃
Figure 5는 650℃의 N2-O2-CO2-KCl(s) 가스환경에서 산화된 Fe-1.25Cr-0.5Mo 시험편의 산화층 단면에 대한 EDS 원소분포도를 나타낸 것이다. 산화층 단면은 앞선 Figure 4의 미침적 시편과 비교하여 다른 형상을 나타냈다. KCI에 침적된 시편은 미 침적 시편 대비 약 2배 이상의 두꺼운 산화층을 형성하였다. KCl에 의한 산화층 성장은 “활성산화” 메커니즘에 기인한 것이다. 고온의 산화환경 하에서 초기 금속재료 표면에는 식 (1), 식 (2)와 같이 산화층이 형성된다.

SEM image and EDS element map for the Fe-1.25Cr-0.5Mo steel in the N2-O2-CO2-KCl(s) gas environment at 650 ℃
| (1) |
| (2) |
이후 고온에서 용융된 KCl은 식 (3), 식 (4)와 같이 산화물과 반응하여 저 융점의 크로메이트(Chromate)를 형성한다.
| (3) |
| (4) |
이러한 과정에서 형성된 Cl2 기체는 산화막을 통해 빠르게 침투하며, 금속/산화층간의 경계에서 식 (5), 식 (6)과 같이 금속과 반응하여 금속염화물을 형성한다
| (5) |
| (6) |
금속/산화층간의 경계에 형성된 금속 염화물들은 677 ℃ 부근에서 용융되며, 식 (7), 식 (8)과 같이 산소와 결합하여, 산화를 촉진한다.
| (7) |
| (8) |
이처럼 금속염화물의 휘발과 재 산화과정이 반복되는 것을 “활성산화” 라고 한다[20]. 금속 염화물 FeCl2와 CrCl2의 융점은 677 ℃와 845℃이다. 이는 본 실험 조건인 650 ℃보다 높은 온도이다. 그럼에도 불구하고 금속 염화물 분해에 의한 활성산화가 나타난 이유는 금속 염화물과 알카리 염화물이 공존할 시 융점이 낮아지기 때문이다[16][20]. 산화층 전체에 걸쳐 검출된 미량의 K와 Cl은 활성산화의 흔적으로 판단된다.
Figure 6은 650℃의 N2-O2-CO2 가스환경에서 산화된 Fe-1.25Cr-0.5Mo 강의 표면을 주사전자현미경으로 관찰한 것이다. 산화층 표면에는 휘스커 (Whisker) 형태의 Fe-산화물이 관찰되었으며, 이후 시간경과에 따라 표면 전체에 걸쳐 성장하는 경향이 관찰되었다.
Figure 7은 650℃의 N2-O2-CO2-KCl(s) 가스환경에서 산화된 Fe-1.25Cr-0.5Mo 강의 표면을 주사전자현미경으로 관찰한 것이다. 시험 전 도포되었던 KCl 결정은 100시간 이내에서 모두 분해 및 산화됨에 따라 관찰되지 않았으며, 표면에서 관찰되는 균열 및 박리된 산화층은 냉각 과정에서 발생한 열팽창에 의한 것으로 판단된다[21].

Surface of oxide layer for the Fe-1.25Cr-0.5Mo steel in the N2-O2-CO2-KCl(s) gas environment at 650 ℃
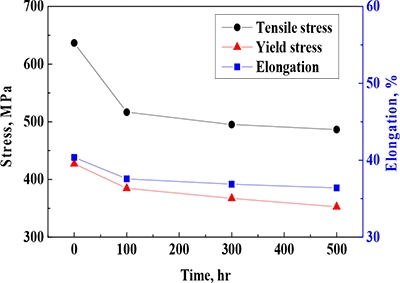
Figure 8은 650℃의 N2-O2-CO2-KCl(s) 가스환경에서 산화된 Fe-1.25Cr-0.5Mo 강에 대한 기계적 물성치를 시간에 따라 나타낸 것이며, 그에 대한 상세한 값을 Table 1에 나타내었다. 인장강도와 항복강도는 100시간에서 다소 큰 폭으로 저하한 이후, 시간경과에 따라 점진적으로 감소되는 경향을 나타냈다. 인장강도와 항복강도는 실험 초기 100시간에서 조직 열화에 따른 연화효과와 산화층 형성에 따른 단면적 감소로 인하여 다소 큰 폭으로 저하되는 경향을 나타냈다[22][23]. 최종 500시간에서 인장강도와 항복강도는 각각 486.69 MPa과 357.72 MPa이며, 이는 모재(636.77 MPa/427.23 MPa) 대비 약 23.57%와 17.44%의 큰 저하율이다.

Detailed mechanical properties of the Fe-1.25Cr-0.5Mo steel in the N2-O2-CO2-KCl(s) gas environment at 650 ℃
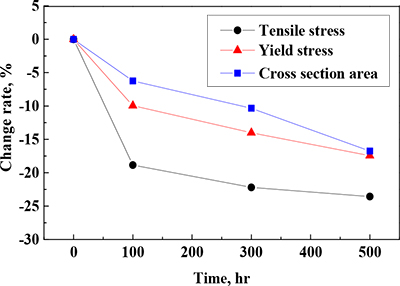
표면 산화와 내구성 간의 연관성을 고찰하기 위해 Figure 3의 산화층 두께로부터 산출한 단면적 감소율과 강도 저하율을 상호 비교하였으며, 이를 Figure 9에 나타냈다. N2-O2-CO2-KCl(s) 가스환경에서 산화된 Fe-1.25Cr-0.5Mo 강표면에는 내부 결합을 가진 Fe-풍부상의 산화물이 주로 형성되었으며, 모재와 접착력이 약해 작은 인장하중 및 외부충격에도 쉽게 박리되었다. 모재와의 접착성이 불량한 Fe-산화층의 성장은 재료의 단면적 감소를 야기하며, 이에 따라 재료 강도는 저하된다. Fe-1.25Cr-0.5Mo 강의 인장 및 항복강도는 단면적이 감소함에 따라 저하되는 경향을 나타냈다. 100시간에서 강도 감소율은 단면적 감소율보다 더 큰 감소율을 나타냈다. 이는 고온에 의한 재료의 연화현상과 Cr-rich 산화막 및 탄화물 형성에 의한 기지 내 Cr 농도 감소 등의 조직열화와 산화층 형성에 의한 단면적 감소 효과가 복합적으로 나타난 것으로 판단된다.
4. 결론
650℃의 N2-O2-CO2 가스환경 하에서 KCl 침적에 의한 Fe-1.25Cr-0.5Mo 강의 산화 및 강도저하 특성을 최대 500시간까지 평가하였으며, 그 결과는 다음과 같다.
KCl 침적 시편은 미 침적 시험편 대비 약 3.0~4.0배의 큰 무게증가량을 나타냈으며, 표면 KCl 침적에 의한 Fe-1.25Cr-0.5Mo 강의 산화가속 영향을 확인할 수 있었다. KCl 침적에 따른 산화가속은 시험초기 강하게 나타났으며, 시간경과에 따라 감소하였다. KCl 침적에 따른 산화가속은 시험초기 강하게 나타났으며, 시간경과에 따라 그 효과는 감소하였다. 표면 산화층은 Fe2O3와 Fe3O4가 공존하는 외부층과 FeO의 내부층으로 구성된 다층 구조를 나타냈다. 표면에 형성된 접착력과 내구성이 불량한 Fe-산화층은 재료의 단면적 감소를 야기함에 따라 인장강도와 항복강도를 저하시켰다. 시험 초기 강도 저하는 열화온도에 따른 연화에 주로 영향을 받았으며, 이후 시간 경과에 따라 Fe-산화층 형성에 따른 단면적 감소에 비례하여 감소하는 경향을 나타내었다.
Acknowledgments
본 연구는 2016년도 산업자원통상부의 재원으로 한국에너지기술평가원 (KETEP)의 지원을 받아 수행한 연구 과제입니다(20161110100090).
Author Contributions
The following statements should be used “Investigation, K. H. Jung; Writing-Original Draft Preparation, K. H. Jung; Supervision, S. J. Kim; Writing-Review & Editing, S. J. Kim”.
References
- R. Kumar, V. K. Tewari, and S. Prakash, “Cyclic oxidation behaviour of 1Cr–0.5 Mo (T11) boiler tube steel and its weldments in air at 900 ℃”, Oxidation of Metals, 86(1-2), p89-98, (2016).
- A. S. Khanna, High Temperature Corrosion, 1st. Ed., New Jersey, World Scientific, (2016), (in Korean).
-
M. Cao, L. Liu, Yu Z., L. Fan, L. Ying, and F. Wang, “Studies on the corrosion behavior of Fe-20Cr alloy in NaCl solution spray at 600 ℃”, Corrosion Science, 133, p165-177, (2018).
[https://doi.org/10.1016/j.corsci.2018.01.033]

- D. W. McKee, D. A. Shores, and K. L. Luthra, “The effect of SO2 and NaCl on high temperature hot corrosion”, Journal of the Electrochemical Society, 125(3), p411-419, (1978).
-
S. J. Kim, “Apparatus on corrosion protection and marine corrosion of ship”, Journal of the Korean Institute of Surface Engineering, 44(3), p105-116, (2011), (in Korean).
[https://doi.org/10.5695/jkise.2011.44.3.105]

-
S. J. Lee, J. C. Park, J. H. Lee, and S. J. Kim, “Investigation on optimum corrosion protection condition of S355ML steel with seawater temperature”, Science of Advanced Materials, 10(4), p586-591, (2017), (in Korean).
[https://doi.org/10.1166/sam.2018.2843]

-
J. H. Lee, I. C. Park, J. C. Park, and S. J. Kim, “Effect of applied current density on the corrosion damage of steel with accelerated electrochemical test”, Journal of the Korean institute of surface engineering, 49(5), p423-430, (2016), (in Korean).
[https://doi.org/10.5695/jkise.2016.49.5.423]

-
D. B. Lee, “High-temperature corrosion by chlorides in biomass-fired plants”, Journal of the Korean Institute of Surface Engineering, 49(1), p14-19, (2016), (in Korean).
[https://doi.org/10.5695/jkise.2016.49.1.14]

- S. Viklund, Superheater Corrosion in Biomass and Waste Fired Boilers: Characterisation, Causes and Prevention of Chlorine-Induced Corrosion, Ph.D. Dissertation, Division of Surface and Corrosion Science, KTH Royal Institute of Technology, Sweden, (2013).
- C. H. Kim, H. T. Chung, J. S. Bae, I. S. Jung, and S. S. Lee, “Thermal stress analysis of piping systems in steam-driven power engines”, Journal of the Korea Society For Power System Engineering, 13(6), p35-42, (2009), (in Korean).
- G. Y. Lai, High-Temperature Corrosion and Materials Applications, 1st Ed., ASM international, (2007).
- A. Di Gianfrancesco, Materials for Ultra-Supercritical and Advanced Ultra-Supercritical Power Plants, 1st Ed., Woodhead Publishing, (2016).
-
N. Folkeson, T. Jonsson, M. Halvarsson, L. G. Johansson, and J. E. Svensson, “The influence of small amounts of KCl(s) on the high temperature corrosion of a Fe‐2.25Cr‐1Mo steel at 400 and 50 0℃”, Materials and Corrosion, 62(7), p606-615, (2011).
[https://doi.org/10.1002/maco.201005942]

- D. B. Lee, M. A. Abro, P. Yadav, S. H. Bak, Y. Shi, and M. J. Kim, “Corrosion of Fe-9% Cr-1% Mo Steel at 600 and 700℃ in N2/ (0.5, 2.5)% H2S-mixed Gas”, Journal of the Korean Institute of Surface Engineering, 49(2), p147-151, (2016), (in Korean).
-
P. Mayer, and A. V. Manolescu, “Influence of hydrogen chloride on corrosion of boiler steels in synthetic flue gas”, Corrosion, 36(7), p369-373, (1980).
[https://doi.org/10.5006/0010-9312-36.7.369]

-
H. P. Nielsen, F. J. Frandsen, K. Dam-Johansen, and L. L. Baxter, “The implications of chlorine-associated corrosion on the operation of biomass-fired boilers”, Progress in energy and combustion science, 26(3), p283-298, (2000).
[https://doi.org/10.1016/s0360-1285(00)00003-4]

- D. A. Jones, Principles and Prevention of Corrosion, 2nd. Ed., Upper Saddle River, NY, Prentice Hall, (1996).
- T. Jonsson, N. Folkeson, J. E. Svensson, and M. Halvarsson, “An ESEM in situ investigation of initial stages of the KCl induced high temperature corrosion of a Fe–2.25 Cr–1Mo steel at 400 ℃”, Corrosion Science, 53(6), p2233-2246, (2011).
-
Y. Kawahara, “High temperature corrosion mechanisms and effect of alloying elements for materials used in waste incineration environment”, Corrosion science, 44(2), p223-245, (2002).
[https://doi.org/10.1016/s0010-938x(01)00058-0]

-
Y. S. Li, M. Spiegel, and S. Shimada, “Corrosion behaviour of various model alloys with NaCl–KCl coating”, Materials Chemistry and Physics, 93(1), p217-223, (2005).
[https://doi.org/10.1016/j.matchemphys.2005.03.015]

-
S. R. J. Saunders, M. Monteiro, and F. Rizzo, “The oxidation behaviour of metals and alloys at high temperatures in atmospheres containing water vapour: A review”, Progress in Materials Science, 53(5), p775-837, (2008).
[https://doi.org/10.1016/j.pmatsci.2007.11.001]

-
S. Spigarelli, “Microstructure-based assessment of creep rupture strength in 9Cr steels”, International Journal of Pressure Vessels and Piping, 101, p64-71, (2013), (in Korean).
[https://doi.org/10.1016/j.ijpvp.2012.10.005]

-
A. Aghajani, F. Richter, S. G. Fries, I. Steinbach, and G. Eggeler, “On the formation and growth of Mo-rich Laves phase particles during long-term creep of a 12% chromium tempered martensite ferritic steel”, Scripta Materialia, 61(11), p1068-1071, (2009).
[https://doi.org/10.1016/j.scriptamat.2009.08.031]