전기분해에 의한 해수살균 및 친환경 중화에 관한 연구
Copyright © The Korean Society of Marine Engineering
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0), which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
초록
본 연구에서는 선박 평형수 처리를 위하여 전기분해 방법을 이용한 살균 효과 및 전해 환원법에 의한 용액 중화에 대해 규명하고자 한다. 전기분해 장치에는 양이온만 선택적으로 통과시키기 위하여 분리막을 설치하였으며, 양극과 음극에는 티타늄 불용성 전극을 사용하였다. 전기분해후 살균처리 효과에 대한 분석은 인큐베이터 안에서 24시간 배양 후 관찰하였다. 전기분해 양극반응의 경우, 각 용액에서 수산기의 발생으로 강한 산성을 나타내었으며, 산화환원전위는 800 ~ 1200 mV까지 증가하였다. 음극반응에서는 pH 9 ~ 12로 알칼리 분위기를 나타내었으며, 산화환원전위는 -900 ~ -750 mV까지 감소하였다. 이를 통하여 양 ․ 음극반응을 통하여 선박평형수의 pH 조절이 가능한 것을 확인 할 수 있었다. 또한, 전기분해에 의해 생성된 차아염소산에 의한 살균 작용과 높은 산화환원전위 환경에서 우수한 살균효과를 나타내는 것을 확인할 수 있었다.
Abstract
In this study, we investigated the effect of sterilization and the neutralization of treated ballast water using seawater electrolysis. The electrolysis apparatus has a cation-selective membrane for passing the cation and a titanium electrodein each cell. We examined the sterilization effect after an incubation period of 24 hr. The oxidation reaction during electrolysis caused, the solution to become strongly acidic due to the generation of a hydroxyl group, and the oxidation reduction potentials(ORP) was increased to 800 ‒ 1200mV. After the reduction reaction, the solution became alkaline(pH 9 ‒ 12), and ORP was decreased to – 900 ‒ – 750 mV. It might be possible to control the pH of ballast water through electrolysis. In addition, we demonstrated the effects of sterilization of ballast water containing generated hypochlorous acid using electrolysis under high ORP condition.
Keywords:
Ballast water, Electrolysis, Electrolytic-reduction, Sterilization effect키워드:
선박 평형수, 전기분해, 전해환원법, 살균효과1. 서 론
선박 평형수는 유조선이나 화물선 등에서 하역 작업시 화물을 내리고 출항할 때 선박의 균형을 잡기 위하여 발라스트 탱크에 채우는 물로써, 평형수를 별다른 처리 없이 항구에 방류하게 되면 타 지역의 생물들이 유입되어 심각한 생태계의 파괴를 유발할 수 있다. 그 동안 연간 50억 톤 이상의 선박 평형수의 유입으로 약 7,000종의 해양생물이 전 세계로 이동되어 생태계에 교란을 주고 있으며, 외래종의 유입으로 발생하는 직접적인 단일 피해 금액이 연간 100억 US달러에 이르며 간접적인 피해까지 고려할시 1,000억 US달러에 이를 것으로 추정된다[1][2].
국제해사기구(IMO)는 이러한 문제를 방지하기 위해서 지난 2004년 선박 평형수 관리 협약(BWMS)을 제정하였고, 2017년 9월 8일부터 발효될 예정이다. 이러한 협약에 대응하기 위하여 전 세계적으로 많은 선박 평형수 처리기술이 개발 및 승인되어지고 있다. 일반적으로 선박 평형수의 처리법에는 여과와 분리 같은 기계적 방식, 오존, 자외선 전류 및 열에 의한 물리적 방식, 살 생물제를 첨가하는 화학적 방식 또는 위의 방식을 조합한 하이브리드 방식이 있으며, 이 중 전기분해 방식이 많이 채택되어 이용되어져 오고 있다[3][4].
전기분해 방식은 선박에서 전기분해를 통해 직접 차아염소산(HClO)을 생성하기 때문에, 살균에 필요한 별다른 약품처리를 필요로 하지 않고, 비교적 높은 살균력을 가졌다는 장점이 있다. 그러나 다시 바다로 살균 처리한 선박 평형수를 배출할 시에 중화제를 사용하여야하는 단점을 가지고 있다[5].
본 연구에서는 수돗물, 3% NaCl 수용액 및 바닷물을 대상으로 하여 전기 분해법에 의한 살균 효과를 검토하였으며, 전해 환원법에 의해 음극반응을 이용하여 용액의 중화를 시도하였다. 그리고 시간에 따른 산화환원전위(ORP, Oxidation-Reduction Potential) 및 pH를 측정하고 살균 효과를 평가하였다.
2. 실험방법
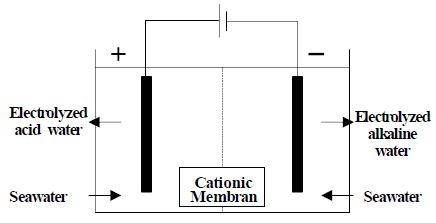
Figure 1은 전기분해 장치의 모식도이다. 장치의 구성은 양극, 음극, 분리막과 외부 전원으로 구성되어 있으며, 분리막은 양극과 음극의 사이에 설치되어 있어 양이온만 선택적으로 통과시키는 역할을 하여 양극용액과 음극용액의 생성물 및 pH가 다르게 유지하는 것이 가능하다[6].
이 때 양극 및 음극은 티타늄에 백금코팅 처리한 불용성 전극을 사용하였으며, 전원장치로는 DC 0 ~ 50 V까지 출력이 가능한 3KW programmable power supply (TDP-3000, Techdine)를 사용하였다. 전기분해 반응을 유도하기 위해 상온에서 ~ 40 V의 전압을 15분간 인가하였으며, 실시간으로 ORP (HM-31P, Toadkk)와 pH (HM-31P, Toadkk)를 측정하였다. 양극반응으로 인해 산화된 용액에 역전압을 가해줌으로써 음극반응을 유도하여 전기분해의 가역반응을 통해 중화작용을 실시하였다. 용액은 수돗물, 3% NaCl 수용액 및 바닷물을 사용하였으며, 바닷물은 부산항 내의 연안에서 채취하였다. 세가지 용액 모두 전기분해 전 24시간 안정화를 실시하였으며, 용액의 용량은 1 L로 하였다. 살균 효과 평가는 양극 반응 5분단위로 37 ℃의 인큐베이터(SLI-700, EYELA)에서 24시간동안 배양하여 관찰하였다.
3. 실험결과
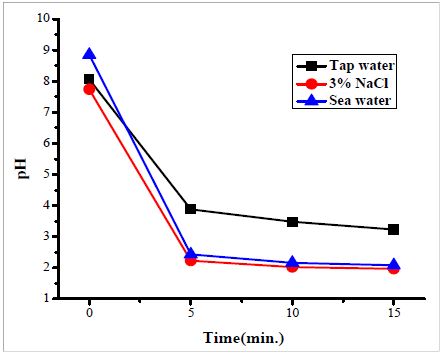
Figure 2는 수돗물, 3% NaCl 수용액 그리고 바닷물에서 전기분해 반응 전․후의 pH의 변화를 나타내었다. 전기분해 반응 결과, 수돗물은 pH 8.06에서 pH 3.23, 3% NaCl 수용액은 pH 7.74에서 pH 2.02, 바닷물의 경우 pH 8.85에서 pH 2.08으로 세 용액 모두 시간의 경과에 따라 pH는 감소하는 경향을 나타내었다. 그러나 수돗물의 pH 변화는 바닷물과 3% NaCl 수용액에 비해 변화폭이 적게 나타났으며 이것은 물속에 용해되어 있는 NaCl의 유무에 기인한 것으로 사료된다[7]. 특히 NaCl이 포함되어 있는 환경에서 양극의 전기화학적 반응은 식 (1) ~ (3)과 같이 반응하여 HCl이 형성하는 것이 가능하며, 또한 반응 생성물 HClO은 박테리아나 바이러스 등의 유기물질을 산화하는 역할을 하는 것으로 알려져 있다[6][7].
| (1) |
| (2) |
| (3) |
그리고 음극에서의 전기화학적 반응은
| (4) |
| (5) |
로써 H2O가 환원되어 OH-와 H2를 형성하고, 분리막 통과한 Na+과 OH-이 반응하여 NaOH를 생성하고 용액의 pH를 알칼리로 유지한다.
Figure 3은 각 용액의 양극반응 중의 ORP의 변화를 나타내었다. ORP란 어떤 물질이 전자를 잃고 산화되거나 또는 전자를 받고 환원되려는 경향의 강도를 나타내는 것으로 ORP는 Nernst Equation을 통하여 아래와 같은 식 (6)으로 나타낼 수 있다[8].
| (6) |
이 때, T0 표준산화환원전위, R은 이상기체 상수, T는 절대온도, n은 이동하는 전자의 몰수, F는 패러데이 상수, Aox는 산화된 물질의 활동도, Ared는 환원된 물질의 활동도를 나타내고 단위는 mV를 사용한다. 본 실험에서 표준산화환원전위 E0는 1.63V(eq 3)이다[9]. 식 (6)에서 상수를 제외한 나머지 항이 양의 값을 가지고 있을 경우, 그 용액은 산화제로서 작용하고 있음을 나타내고 더 높은 값을 가지고 있을수록 환원된 물질의 활동도에 비해 산화된 물질의 활동도가 지수배로 존재하고 있음을 나타낸다. 또한 두 번째 항이 음의 값을 가지고 있을 경우 그 물질은 환원제로서 작용하고 있고 더 낮은 값을 가지고 있을 경우 더 높은 환원 물질이 존재하고 있음을 나타낸다[6].
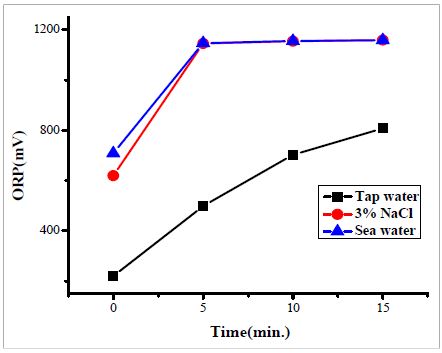
각 용액에서의 시간의 경과에 따른 ORP의 변화에 확인결과, 수돗물은 219 mV에서 808 mV, 3% NaCl 수용액은 620 mV에서 1160 mV, 바닷물의 경우 709 mV에서 1159 mV으로 증가하였다. 특히, NaCl이 포함되어 있는 용액들에서는 5분 사이에 급격한 전위변화를 나타내었으며 1200 mV 가까이에서 포화되는 경향을 나타내었으며, 수돗물의 경우 상대적으로 느린 변화를 나타내는 것을 확인할 수 있었다. 이것은 각 용액별 시간에 따른 pH 변화거동과 일치하는 결과를 나타내며, 양극반응에서의 생성물 농도차이에 의한 것으로 사료된다.
Figure 4에는 Robbs 등의 ORP, pH와 염소 농도의 상관관계에 대한 연구결과를 나타내며, 전기분해에 의한 양극반응 생성물의 ORP는 염소농도에 따라 증가하는 경향을 확인 할 수 있었다[10]. 또한 pH가 낮을수록 ORP가 더욱 높은 값을 유지하였고, pH 8에서 pH 6으로 낮아질 경우, ORP는 대략 200 mV의 증가하는 경향을 보였다. 이러한 염소농도 및 pH에 따른 ORP의 변화는 본 연구의 Figure 2 및 Figure 3의 결과와 일치한다.
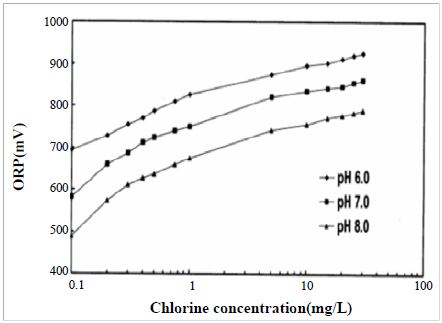
ORP of Chlorine solutions at concentrations of 0.1-30 mg of free chlorine per liter at pH 6.0, 7.0, or 8.0 [10].
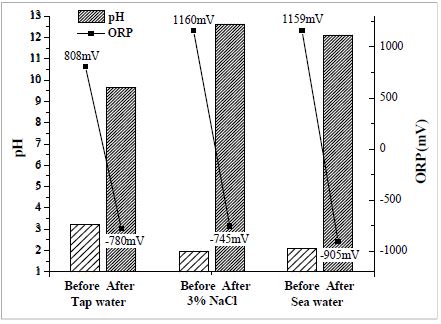
Figure 5는 양극반응을 15분간 실시한 양극용액에 음극반응을 15분간 가해주었을 때의 pH의 변화추이를 나타내었다. 전기분해 양극반응 후에는 pH 2 ~ 3의 강산성 상태였으나, 역전압을 가하여 음극반응을 유도하였을 때에는 약 pH 9 ~ 12의 알칼리 상태로 변화하였다. 또한, ORP의 값이 약 +800 ~ 1200 mV 이었던 것에 반해, 음극반응 후의 약 -900 ~ -750 mV로 변화한 것을 확인 할 수 있었다. 이는 양극반응에서 생성된 반응생성물이 음극반응에서 생성된 반응생성물에 의해 분해반응을 일으킨 것으로 사료된다[11]. 이를 통해 양극반응으로 인해 생성된 반응생성물 및 용액의 강산성 상태를 음극반응을 이용하여 용액의 pH를 조절할 수 있는 것을 확인하였다.
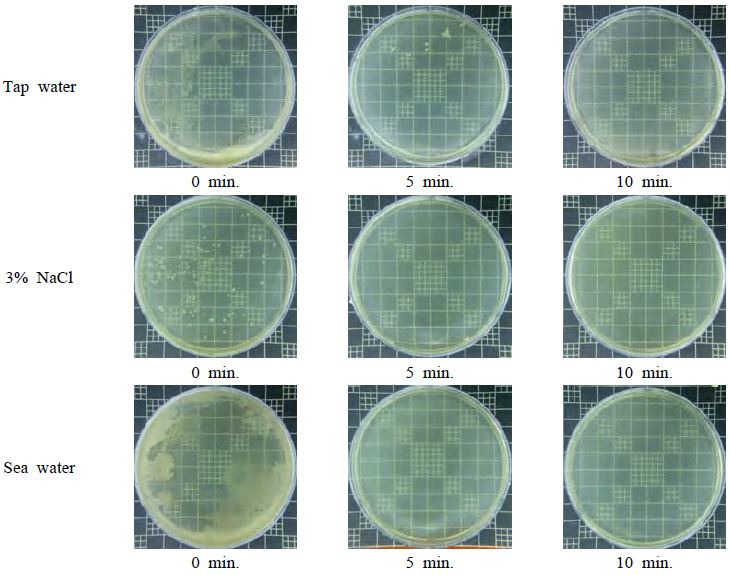
Figure 6에는 시간경과에 따른 각 용액에서의 전기분해 살균효과를 나타내었다. 수돗물의 경우, 양극반응 5분 후에 추출하여 배양 후 관찰한 결과 유리 샬레(schale) 상단 표면에 흰색 점막형태의 균들이 남아있음을 확인할 수 있었다. 그러나 3% NaCl 수용액과 바닷물 환경에서는 어떤 균도 확인되지 않았다. 그리고 세가지 용액 모두 10분 후에는 균이 남아 있지 않았다. 이상의 결과로부터 전기분해에 의해, 살균처리가 가능한 것을 확인할 수 있었다. 이것은 염이 포함된 용액에서 전기분해에 의해 생성된 HClO에 의해 균의 산화작용과 ORP가 높을수록 살균효과가 빠르고 좋은 것으로 사료된다[7][12].
4. 결 론
수돗물, 3% NaCl 수용액, 바닷물에 전기분해 양극반응 및 음극반응을 각각 15분간 실시하였으며, 다음과 같은 pH, ORP의 변화 및 살균효과를 확인하였다.
- 1) pH, ORP의 변화 : 전기분해 양극반응의 경우, 세 용액 모두 H+ 발생으로 pH가 pH 2 ~ 3 강산성으로 변화하였으며, ORP는 800 ~ 1200 mV까지 증가하였다. 음극반응을 가해였을 때에는 분해반응으로 인하여 pH 9 ~ 12인 알칼리까지 변화하였으며, ORP는 -900 ~ -750 mV까지 감소하였다. 이를 통하여 양극반응, 음극반응을 통하여 pH의 조절 가능한 것을 확인 할 수 있었다.
- 2) 살균효과 : NaCl 이 함유된 해수 및 3% NaCl 용액에서 짧은 시간에 균이 제거되는 것을 확인 할 수 있었으며, 이것은 염의 함유된 용액에서 전기분해에 의해 생성된 HClO에 의한 살균작용과 높은 ORP 환경에서 우수한 살균효과를 나타내었다.
References
- D. Pughiuc, “Invasive species : Ballast water battles”, Seaways, March), p5-7, (2010.
-
S. G. Cheon, D. W. Park, and G. S. Kil, “Development of an ultra-violet lamp and a ballast for ship’s ballast water treatment”, Journal of the Korean Society for Marine Engineering, vol. 35(no. 5), p675-681, (2011), (in Korean).
[https://doi.org/10.5916/jkosme.2011.35.5.675]

- Lloyd's Register, Ballast Water Treatment Technologies and Current System Availability, London, p3-13, (2012).
- Lloyd's Register, Understanding Ballast Water Management, 3rd ed., London, United Kingdom, p4-19, (2016).
-
E. C. Kim, J. H. Oh, and S. G. Lee, “Consideration on the concentration of the active substances produced by the ballast water treatment system”, Journal of the Korean Society for Marine Environmental & Energy, vol. 15(no. 3), p219-226, (2012).
[https://doi.org/10.7846/jkosmee.2012.15.3.219]

-
K. Kumon, “What is functional water?”, Artificial Organs, vol. 21(no. 1), p2-4, (1997).
[https://doi.org/10.1111/j.1525-1594.1997.tb00688.x]

-
S. Y. Hsu, “Effects of flow rate, temperature and salt concentration on chemical and physical properties of electrolyzed oxidizing water”, Journal of Food Engineering, vol. 66( no.2), p171-176, (2005).
[https://doi.org/10.1016/j.jfoodeng.2004.03.003]

- D. A. Jones, Principles and Prevention of Corrosion, 2nd ed., New Jersey, USA, Prentice Hall, (1996).
-
L. B. Liao, W. M. Chen, and X. M. Xiao, “The generation and inactivation mechanism of oxidation-reduction potential of electrolyzed oxidizing water”, Journal of Food Engineering, vol. 78(no. 4), p1326-1332, (2007).
[https://doi.org/10.1016/j.jfoodeng.2006.01.004]

- P. G. Robbs, J. A. Bartz, J. K. Brecht, and S. A. Sargent, “Oxidation-reduction potential of chlorine solutions and their toxicity to Erwinia carotovora subsp. carotovora and Geotrichum candidum”, Plant Disease, vol. 79(no. 2), p158-162, (1995).
-
H. Kiura, K. Sano, S. Morimatsu, T. Nakano, C. Morita, M. Yamaguchi, T. Maeda, and Y. Katsuoka, “Bactericidal activity of electrolyzed acid water from solution containing sodium chloride at low concentration, in comparison with that at high concentration”, Journal of Microbiological Methods, vol. 49(no. 3), p285-293, (2002).
[https://doi.org/10.1016/s0167-7012(01)00385-2]

- T. V. Suslow, Oxidation-reduction potential (ORP) for water disinfection monitoring, control, and documentation, Califonia, USA, ANR Publication 8149, (2004).